Introduction
La liaison covalente est la réponse de la nature pour permettre à certains éléments chimiques de gagner en stabilité. En effet, la structure électronique de certains éléments chimiques ne permet pas à cet élément d’exister à l’état isolé sous forme d’ion. Pour gagner en stabilité, ils ne leur restent qu’une possibilité : l’échange avec un autre élément chimique qui lui aussi cherche à compléter sa dernière couche électronique pour gagner en stabilité.
Attention, ici il n’y a pas d’échange définitif d’électron (pas de gain ni de perte) comme dans le cas de la formation d’un ion, mais plutôt une mise en commun. Chaque élément chimique apporte un électron pour former une paire (comprendre une liaison covalente). Dans cette paire chaque élément chimique reste propriétaire de son électron et « emprunte » ou « fait comme si » l’électron de l’autre élément chimique était le sien.
Résultat : il faut rester à coté de son partenaire pour que l’échange persiste, sans quoi chacun reprend son électron et on se retrouve en instabilité.
Définition
La liaison covalente est donc un échange d’électron entre deux éléments qui ont besoin de récupérer un ou plusieurs électrons pour satisfaire la règle de stabilité du duet ou de l’octet.
Exemples :
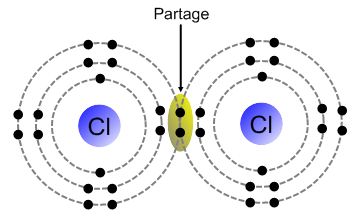
ou encore
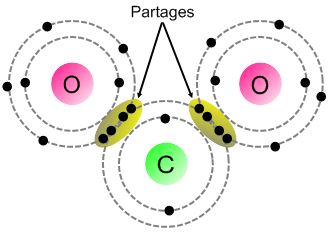
| Élément chimique | H | C | O | N | Cl |
|---|---|---|---|---|---|
| Nombre de liaisons covalentes | 1 Car (K)1 |
4 Car (L)4 |
2 Car (L)6 |
3 Car (L)5 |
1 Car (L)7 |
Pour aller plus loin :
